京都大学 全学共通教育 基礎化学実験ホームページ:http//wwwchemzenkyohkyotouacjp/化学実験操作法:操作法 2 4 キレート錯体・キレート平衡の計算問題 その1演習問題 このときの濃度は亜鉛イオンに制限され、Zn(NH3)4^2 = mol/L で、アンモニアの濃度はほぼ変化していないとみなし(近似し)005molのままと考えます。キレート滴定 1.目的 キレート滴定法を用いて、未知試料中に含まれる金属イオン(Ca 2+、Mg 2+)の濃度 を調べ、さらに水の硬度についても計算して求める。また、実験を通してキレート滴定法 の原理や操作の仕方について学び、結果の考察をしてさらに理解を深める。

ミネラル サプリ キレート 滴定
キレート滴定 計算 亜鉛
キレート滴定 計算 亜鉛-キレート滴定 1.目的 キレート滴定法を用いて、未知試料中に含まれる金属イオン(Ca 2+、Mg 2+)の濃度 を調べ、さらに水の硬度についても計算して求める。また、実験を通してキレート滴定法 の原理や操作の仕方について学び、結果の考察をしてさらに理解を深める。I キレート滴定による亜鉛イオン濃度の決定 1 キレート滴定におけるチオ硫酸ナトリウムの役割を説明せよ。 2 滴定の結果に基づき試料中の亜鉛イオンの濃度を求めよ。 ii ヨウ素還元滴定による銅イオン濃度の決定 1 滴定過程の化学反応式を書け。 2


条件錯生成定数を求める問題です 0 2mol Lのznイ Yahoo 知恵袋
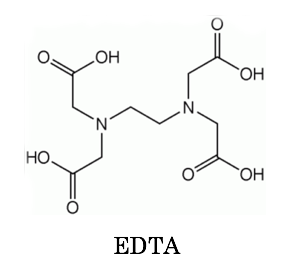
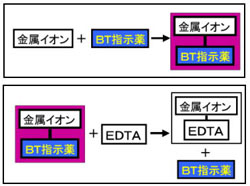
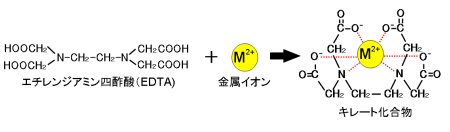
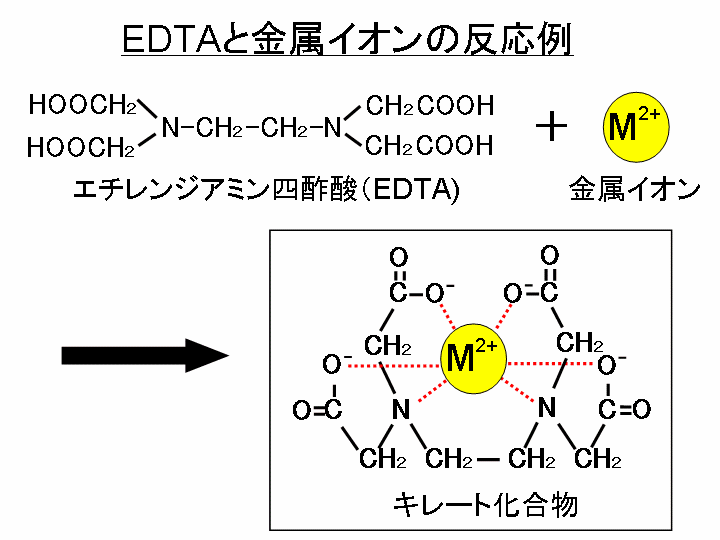
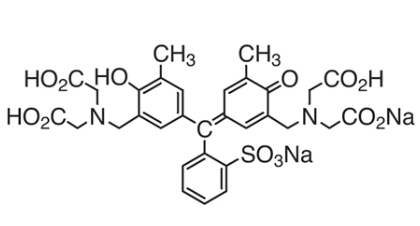
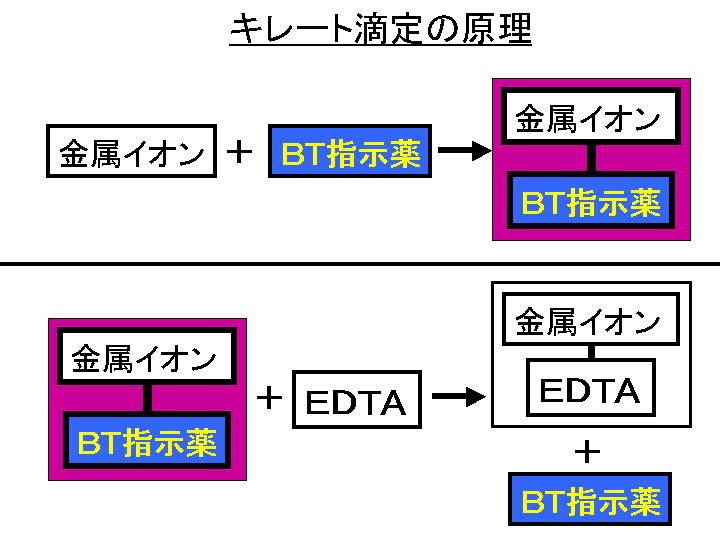
キレート滴定に汎用されるキレート試薬;EDTA(六座配位子) ethylenediaminetetraacetic acid エチレンジアミン四酢酸 >NCH 2CH 2N< CH 2 COOH HOOCH C CH 2 COOH HOOCH C EDTAと金属との反応比は1:1 試薬としては 2Na塩を入手 M Y MY K MY = MY/MY キレート生成定数I キレート滴定による亜鉛イオン濃度の決定 1 キレート滴定におけるチオ硫酸ナトリウムの役割を説明せよ。 2 滴定の結果に基づき試料中の亜鉛イオンの濃度を求めよ。 ii ヨウ素還元滴定による銅イオン濃度の決定 1 滴定過程の化学反応式を書け。 2となる。 キレート滴定では、この至適 pH を保つために緩衝液が用いられる! XIII13 補助錯化剤 一般にキレート滴定はかなり高い pH で行なうが、このとき金属水酸化物を沈殿させな いように、 EDTA より Kf の小さい錯化剤(=補助錯化剤 )を共存させることが
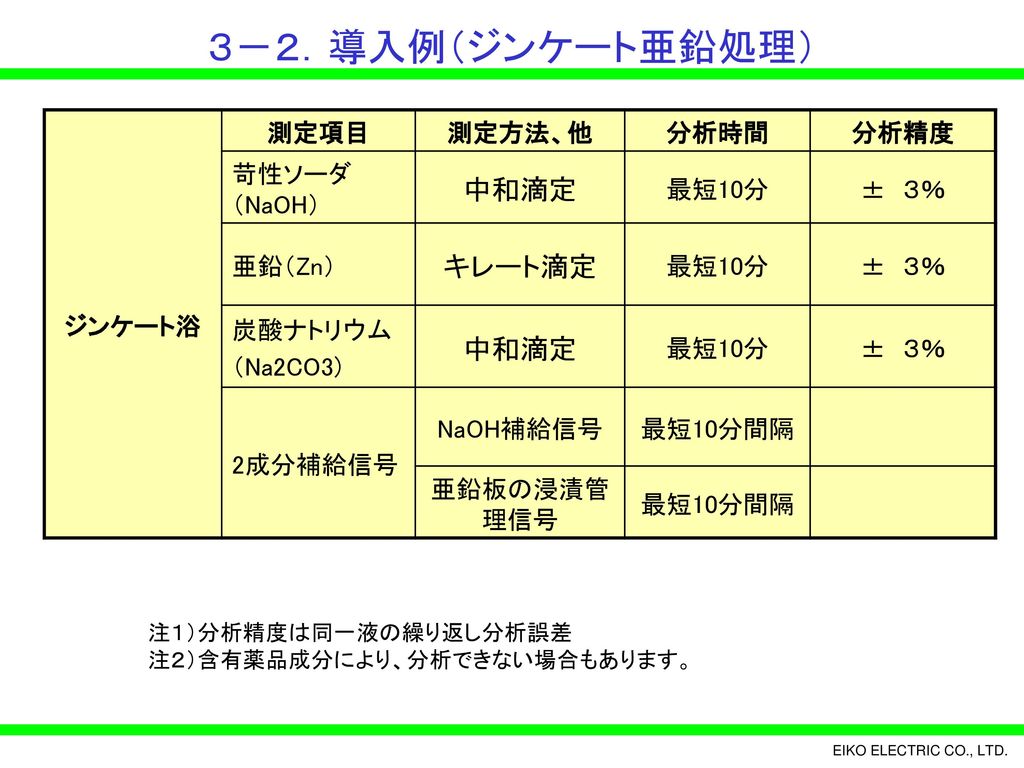
問題28 キレート滴定法による銅と亜鉛の定量 合金は、日々の生活の様々な場面で使用されている。とりわけ、その特性(たとえ ば伝導性,機械的特性あるいは耐食性など)により、合金は航空学,建築,電子機器水の硬度とは、水に溶けているCa 2+ およびMg 2+ の量をCaCO 3 (ppm)に換算したものである。 硬度には、全硬度(Ca 2+ とMg 2+ )、Ca硬度、およびMg硬度がある。 EDTA(エチレンジアミン四酢酸)は、最大6本の腕(6座配位)で2価~4価の金属イオンと、そのイオンの価数に関係なく1:1で結合しニッケル分はキレート滴定(光度検出)で行います。 ⑤ 0.05mol/L-EDTA溶液で滴定します。(オレンジ→赤紫) シート№ : gt0ps017 2/3 計算式
水の硬度とは、水に溶けているCa 2+ およびMg 2+ の量をCaCO 3 (ppm)に換算したものである。 硬度には、全硬度(Ca 2+ とMg 2+ )、Ca硬度、およびMg硬度がある。 EDTA(エチレンジアミン四酢酸)は、最大6本の腕(6座配位)で2価~4価の金属イオンと、そのイオンの価数に関係なく1:1で結合しキレート滴定の計算方法 1 試薬の体積と初濃度 塩化アンモニウムNH 4 Cl-アンモニア水NH 3 系のpH緩衝液により,常にpH=10一定であると仮定する.計算を簡単化するために,カルシウムイオンCa 2 やマグネシウムイオンMg 2 と指示薬のエリオクロムブラックT(EBT)の錯体形成反応(化学平衡)を金属イオンの滴定法をキレート滴定法と呼ぶのもそのた めです 3 滴定試薬としての応用(キ レート滴定法) 3・1 キレート滴定法の原理 ふたたび反応式(iii)に ついて考えてみましょう あ る金属イオン(m)の 水溶液にedta溶 液(y)を 滴


2cのページ



第98回薬剤師国家試験 問96 Yakugaku Lab
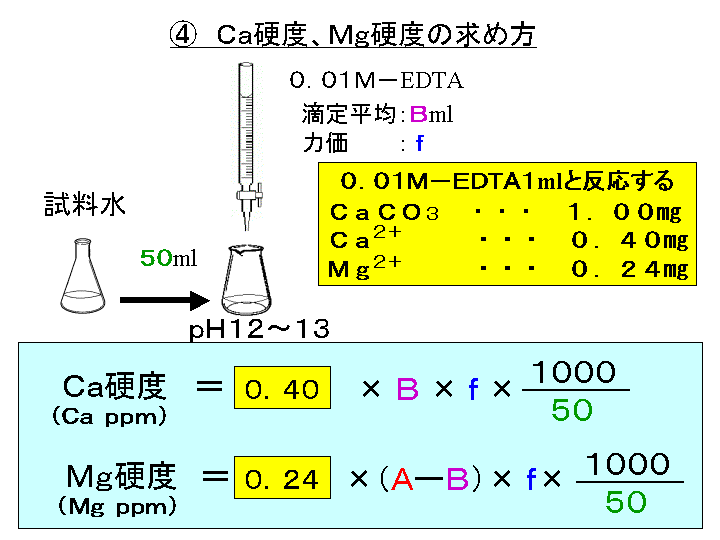
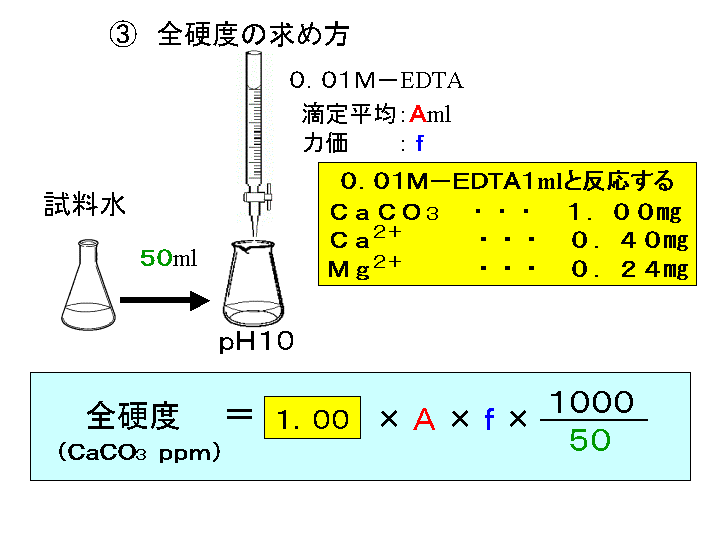
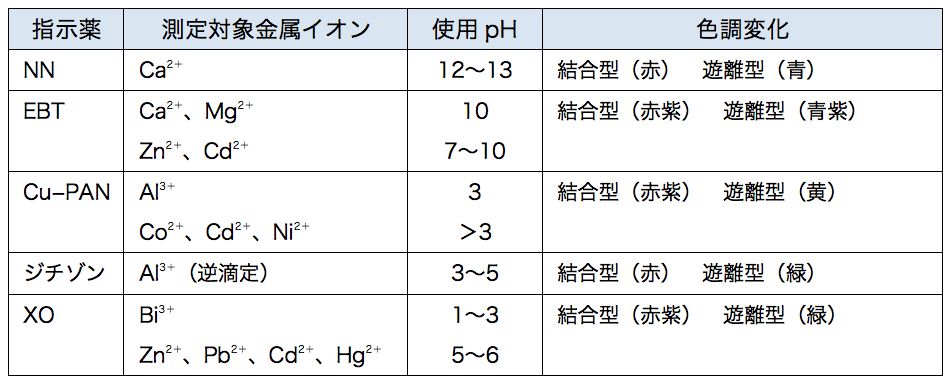
ビュレットの0.01M-EDTA標準溶液で滴定を行う。 溶液の色が赤紫色から青色になったところを終点とする。 6) 1~5を3回繰り返し、滴定平均値を求める。 7) Ca硬度を計算し求める。 8) Mg硬度を計算し求める。亜鉛イオン(Zn2)は、キレート滴定によって容易に定量できます。亜鉛のEDTA による滴定が できるpH 領域(pH45~10)は広くかつEDTA に対する安定度定数も大きく、鋭敏に変色する 指示薬も多く存在します。亜鉛イオン(Zn 2 )は、キレート滴定によって容易に定量できます。亜鉛のEDTA による滴定ができるpH 領域(pH45~10)は広くかつEDTAに対する安定度定数も大きく・・・


水の硬度測定 キレート滴定



キレート滴定法の意味 用法を知る Astamuse
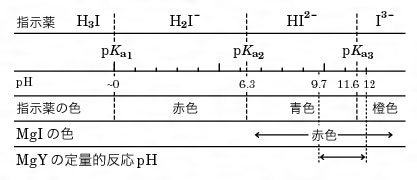
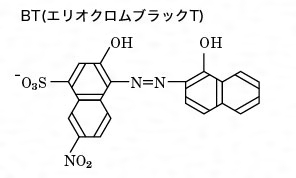
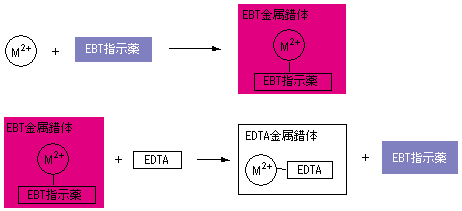
キレート滴定 1.目的 キレート滴定法を用いて、未知試料中に含まれる金属イオン(Ca 2+、Mg 2+)の濃度 を調べ、さらに水の硬度についても計算して求める。また、実験を通してキレート滴定法 の原理や操作の仕方について学び、結果の考察をしてさらに理解を深める。ビュレットの0.01M-EDTA標準溶液で滴定を行う。 溶液の色が赤紫色から青色になったところを終点とする。 6) 1~5を3回繰り返し、滴定平均値を求める。 7) Ca硬度を計算し求める。 8) Mg硬度を計算し求める。キレート滴定における終点の検出 金属指示薬:金属イオンの濃度変化により鋭敏に変色 (指示薬も金属イオンとキレートを形成する) エリオクロムブラックt (ebt) n n oh oh so 3 h no 2 h3in 2 ph 変化に伴うebt 指示薬の色調変化 n n oh oh so 3 h no 2 h3in pka1=16 pka2=63


容量分析の実験 参考文献 基礎分析化学 新 物質科学ライブラリ 1 容量分析の基礎 原子吸光やicp 蛍光x線などの機器分析では 有効数字が2 3桁程度であるのに対し 湿式分析 容量分析 や重量分析では4桁が可能である 容量


化学キレート滴定の問題です 赤線引いたところの意味がわかりません Yahoo 知恵袋
キレート滴定においては、逆滴定用の標準液として、塩化マグネシウム液や酢酸亜鉛液が用いられる。 <標準試薬について> edtaを標定する際には、標準試薬として「亜鉛」が用いられる。 2 金属指示薬となる。 キレート滴定では、この至適 pH を保つために緩衝液が用いられる! XIII13 補助錯化剤 一般にキレート滴定はかなり高い pH で行なうが、このとき金属水酸化物を沈殿させな いように、 EDTA より Kf の小さい錯化剤(=補助錯化剤 )を共存させることが4. 001M亜鉛標準溶液で滴定し、青色が紫色に変わる点を終点とする。 5.滴定結果より、試料溶液250ml中に存在するNiの重量を計算する。 4 4 置換滴定法 定量しようとする金属イオン M12の溶液に M 2Y 2-溶液を加えると、次の平衡が成り立 つ。 M1 2 + M 2Y


薬液処理浴自動管理装置 めっき管理主任シリーズ のご紹介 Ppt Download



黒田真生 Naoki Kuroda در توییتر 正答 1 2 3 エリオクロムブラックt 塩化ナトリウム指示薬である 4 亜鉛とedtaが キレートを作ることによる 5 亜鉛とedtaは1 1で結合するから 0 05 81 38 40 69となる
が,ph6に おいて亜鉛,カ ドミウムのうち,カ ドミウ ムのみと安定なキレートを生成して,edtaに よるキ レート滴定からいんぺいすることが知られているす な わち鉛と同量以下のカドミウムは,ジ メルカプトコハク質問箱 名前: 芦田 実 日時:02年09月22日 14時50分 岸本 博文 様 必ずしも専門家ではありませんので,不正確な回答もあります.教育学部から公開しているホームページの質問箱とQ&A集にも回答(一部)を載せたいと思います. 質問18 キレート滴定法キレート滴定 要旨 まず亜鉛の固体を精秤しこれを酸で溶かす。この亜鉛溶液でedtaを標定し、そのedtaで塩化銅(ii)を標定する。 目的 金属イオンを容量滴定によって標定する方法としては、エチレンジアミン四酢酸(edat)によるキレート滴定が最も一般的である。


滴定曲線 溶解度などーエクセルを用いて


Microsoft Powerpoint 市工研発表資料 最終 配布用 Pptx Pdf Free Download
ムおよび亜鉛ではEDTA錯塩の方がシアノ錯塩よりも 金属イオン濃度が小さく(弟1,2表参照)例えばZn (CN)4 の場合〔CNlが6×10~3モルでNa2ZnY錯 垢と平衡になる。(01モルの場合)。後 の滴定操作に従 う場合,銀,銅および亜鉛またほカドミウムの全部をシ


キレート滴定 Yakugaku Lab


容量分析の実験 参考文献 基礎分析化学 新 物質科学ライブラリ 1 容量分析の基礎 原子吸光やicp 蛍光x線などの機器分析では 有効数字が2 3桁程度であるのに対し 湿式分析 容量分析 や重量分析では4桁が可能である 容量



キレート滴定 Kyo Aroma Breath 京都 京北での精油採取から 暮らしの香りへ
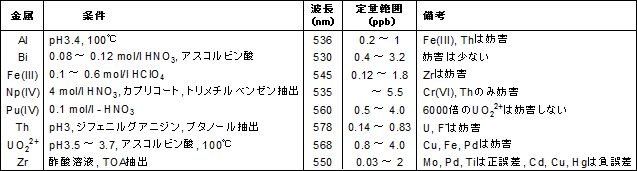


比色試薬 金属指示薬 Xo 同仁化学研究所



キレート滴定 Yakugaku Lab



比色試薬 金属指示薬 Pan 同仁化学研究所



キレート滴定 Yakugaku Lab



17 号 キレート剤の定量方法 Astamuse
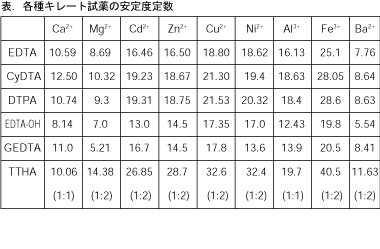


Column


容量分析の実験 参考文献 基礎分析化学 新 物質科学ライブラリ 1 容量分析の基礎 原子吸光やicp 蛍光x線などの機器分析では 有効数字が2 3桁程度であるのに対し 湿式分析 容量分析 や重量分析では4桁が可能である 容量


薬剤師国家試験 第98回 問96 過去問解説 E Rec わかりやすい解説動画


比色試薬 金属指示薬 Xo 同仁化学研究所


キレート滴定とは コトバンク



キレート滴定 Kyo Aroma Breath 京都 京北での精油採取から 暮らしの香りへ


水の硬度測定 キレート滴定
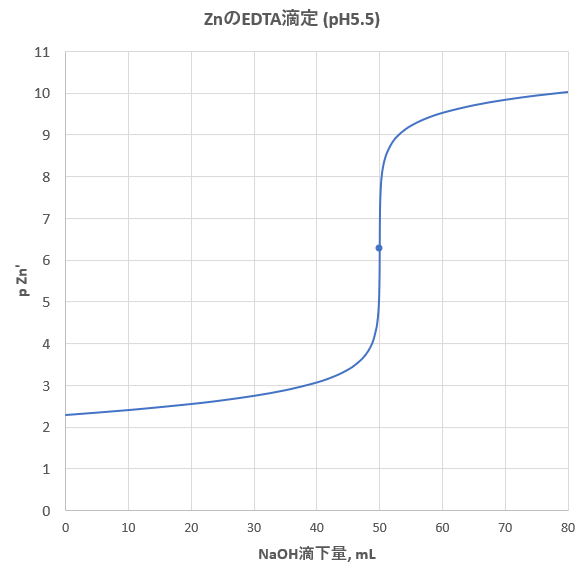


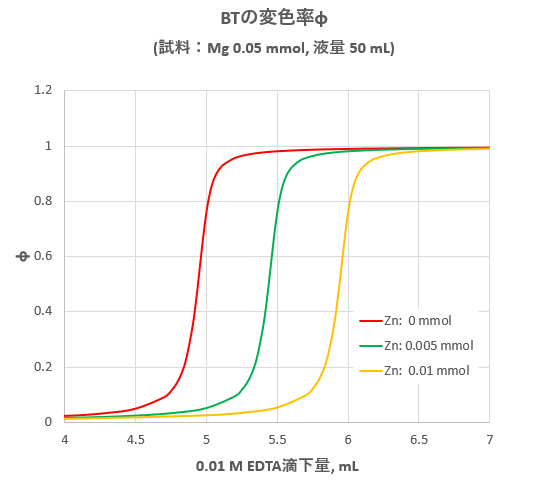
亜鉛のedta滴定 2 滴定曲線 溶解度などーエクセルを用いて


3回生実験のこと 合金の分析


条件錯生成定数を求める問題です 0 2mol Lのznイ Yahoo 知恵袋



キレート滴定 Yakugaku Lab


分析化学 キレート滴定についての質問です 体調不良で講義に出れなかったと Yahoo 知恵袋


2cのページ



7440 66 6 0 01mol L 亜鉛溶液 0 01mol L Zinc Solution 265 詳細情報 試薬 富士フイルム和光純薬



水の硬度測定 キレート滴定



資料広場 代表キーワード キレート滴定 全ての種類 最新資料 詳細リスト ハッピーキャンパス


容量分析の実験 参考文献 基礎分析化学 新 物質科学ライブラリ 1 容量分析の基礎 原子吸光やicp 蛍光x線などの機器分析では 有効数字が2 3桁程度であるのに対し 湿式分析 容量分析 や重量分析では4桁が可能である 容量



ミネラル サプリ キレート 滴定



京都大学 化学実験操作法 操作法 2 4 キレート滴定 Mg イオンの定量 Youtube



キレート滴定 薬学 これでok


キレート滴定とは コトバンク



比色試薬 金属指示薬 Xo 同仁化学研究所



1 1沈殿滴定 塩化ナトリウム 硝酸銀溶液の試料をmohr法 Fajans法を用いての沈澱滴定


水の硬度測定 キレート滴定


水の硬度測定 キレート滴定
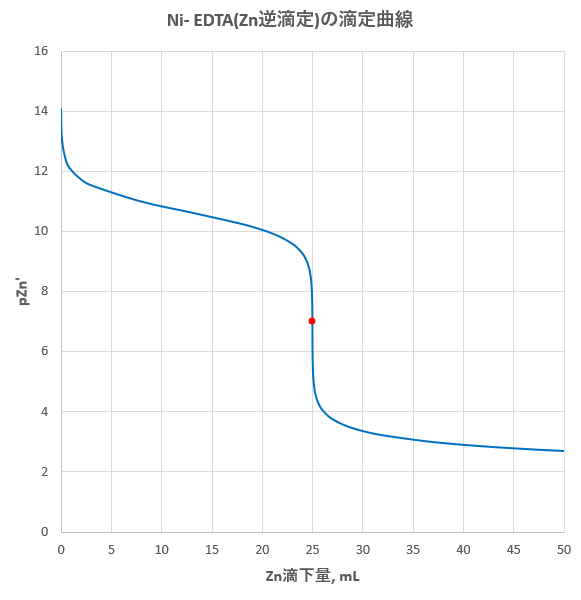


滴定曲線 滴定曲線 溶解度などーエクセルを用いて



キレート滴定 Yakugaku Lab


水の硬度測定 キレート滴定
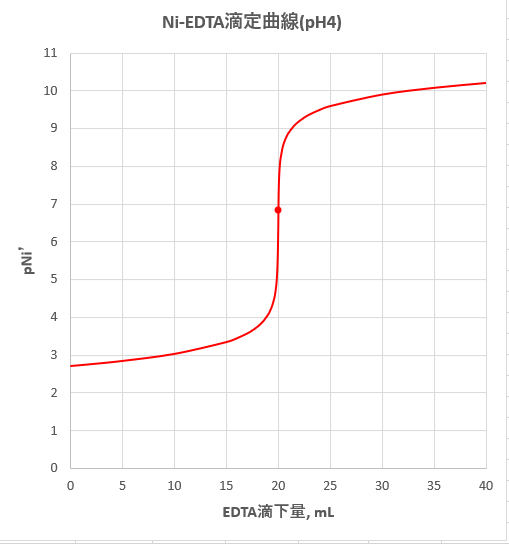


滴定曲線 滴定曲線 溶解度などーエクセルを用いて


容量分析の実験 参考文献 基礎分析化学 新 物質科学ライブラリ 1 容量分析の基礎 原子吸光やicp 蛍光x線などの機器分析では 有効数字が2 3桁程度であるのに対し 湿式分析 容量分析 や重量分析では4桁が可能である 容量



17 号 キレート剤の定量方法 Astamuse


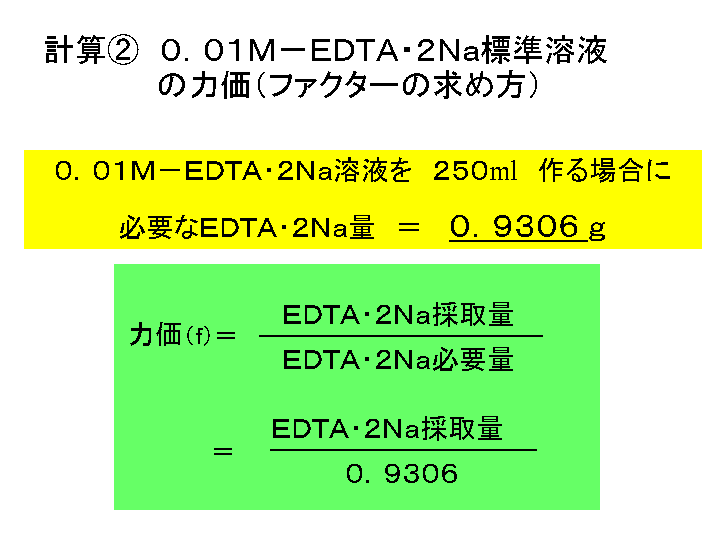
年11月発行 カルシウム塩のキレート滴定について


水の硬度測定 キレート滴定


Microsoft Powerpoint 市工研発表資料 最終 配布用 Pptx Pdf Free Download


年06月 滴定曲線 溶解度などーエクセルを用いて


3回生実験のこと 合金の分析


容量分析の実験 参考文献 基礎分析化学 新 物質科学ライブラリ 1 容量分析の基礎 原子吸光やicp 蛍光x線などの機器分析では 有効数字が2 3桁程度であるのに対し 湿式分析 容量分析 や重量分析では4桁が可能である 容量


水の硬度測定


水の硬度測定 キレート滴定



キレート滴定 Kyo Aroma Breath 京都 京北での精油採取から 暮らしの香りへ


キレート滴定 Yakugaku Lab


キレート滴定 Yakugaku Lab


キレート滴定 Edtaによる水の硬度測定 薬剤師が教える健康情報ブログ


細胞内の亜鉛の新しい生理的役割が明らかに 亜鉛とシャペロンタンパク質erp44による新しいタンパク質品質管理機構の仕組みを解明 プレスリリース Spring 8 Web Site



17 号 可搬型滴定装置 Astamuse



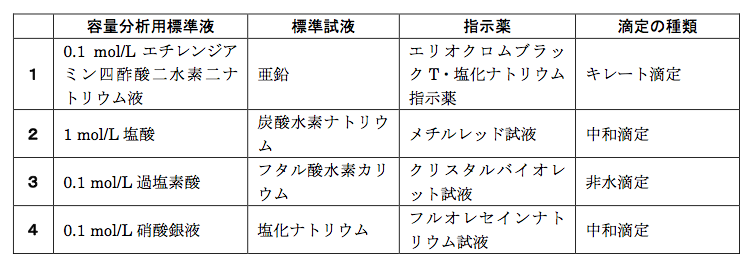
キレート滴定に用いられる主な標準液 指示薬のゴロ ごろごろ覚える薬学生ゴロ 薬剤師国家試験対策



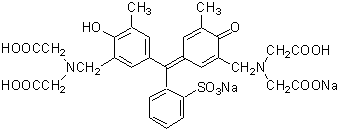
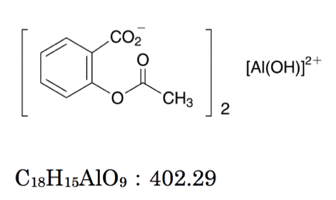
エチレンジアミン四酢酸 Wikiwand



キレート滴定 Yakugaku Lab



0 件のコメント:
コメントを投稿